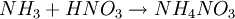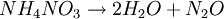El nitrato amónico o nitrato de amonio es una sal formada por iones de nitrato y de amonio. Su fórmula es NH4NO3. Se trata de un compuesto incoloro e higroscópico, altamente soluble en el agua. Conocimientos adicionales recomendadosDatos físico-químicos
SíntesisEl nitrato amónico se obtiene por neutralización de ácido nítrico con amoníaco tras la evaporación del agua: AplicacionesEl nitrato de amonio se utiliza sobre todo como fertilizante por su buen contenido en nitrógeno. El nitrato es aprovechado directamente por las plantas mientras que el amonio es oxidado por los microorganismos presentes en el suelo a nitrito o nitrato y sirve de abono de más larga duración. Una parte de la producción se dedica a la producción del óxido nitroso (N2O) mediante la termólisis controlada: Esta reacción es exotérmica y puede ser explosiva si se lleva a cabo en un contenedor cerrado o calentando demasiado rápido. Las mezclas del nitrato amónico con petróleo se utilizan como explosivos. Este compuesto también es responsable de la mayor parte de los accidentes graves con los fertilizantes:
El nitrato de amonio se ha empleado también en diversos ataques terroristas, como por ejemplo en Irlanda del Norte; en el atentado a la AMIA, en Argentina, en 1994; contra el edificio federal de Oklahoma, Estados Unidos, en 1995; contra la Embajada norteamericana en Nairobi, en 1998; contra un complejo turístico en Bali, en 2002; y más recientemente, en un doble atentado suicida dirigido contra el Consulado de Gran Bretaña y dos locales del banco HSBC en Estambul, en noviembre de 2003. En el año 2000 se realizó por parte de EFMA, un compendio de ocho volúmenes que presentaban los "Mejores procedimientos industriales disponibles para la prevención de la producción y el control en la industria de fertilizantes europea", en respuesta a las normativas europeas[1] y españolas.[2] En la actualidad, existen en Europa, según EFMA, en torno a diez métodos diferentes para la producción industrial del nitrato amónico en sus diferentes riquezas, no existe un único procedimiento que pueda ser considerado como el más ventajoso respecto al resto, debido fundamentalmente a dos razones:
Por ello se incidirá en primer lugar de manera general sobre cada uno de los pasos del proceso, estableciendo a continuación las mejores soluciones que existen para resolver los problemas planteados. Procesos de fabricaciónLa reacción entre el amoníaco y el ácido nítrico es irreversible, completa, instantánea, exotérmica y admite cualquier termodinámica o discusión cinética. El calor de reacción depende de la concentración de ácido nítrico usado y de la solución producida de nitrato amónico, pues la disolución cuanto más concentrada está, mayor es el calor de reacción. Dicho calor de reacción se puede utilizar para producir la evaporación del agua de la solución de nitrato amónico y además para producir vapor. El nitrato amónico puro sufre una descomposición endotérmica a 169 °C y tiene un punto de ebullición de 230 °C. La concentración del ácido nítrico usado normalmente es de 55 a 65 %, mientras su punto de ebullición a presión atmosférica es de 120 °C, más bajo por tanto que la solución producida de nitrato amónico, soluciones altamente concentradas manifiestan altos puntos de ebullición y de congelación. Lo primero puede causar altas temperaturas y por tanto operaciones peligrosas y lo segundo bloqueo de las tuberías. El nitrato amónico conservado a 100 °C por un largo periodo de tiempo sufre una descomposición termal hacia amoniaco y ácido nítrico, descomposición que a más de 185 °C puede producir una explosión peligrosa. La solubilidad de amoniaco en agua decrece rápidamente cuando aumenta la temperatura y la alta volatilidad de los componentes y la descomposición de la sal producida conduce fácilmente a pérdidas ambientales y problemas de corrosión. El control de las variables de la reacción (temperatura, presión, calor utilizado y concentraciones de ácido nítrico y nitrato amónico) y los detalles de construcción, logran la utilización del máximo calor, generándose una mezcla fundida sin adicción de calor externo que al mismo tiempo asegura unas condiciones, todo con el mismo equipo y consumo de energía, en las que se consigue la mayor producción posible y una alta calidad del producto. El proceso de obtención de nitrato amónico básicamente consta de los siguientes pasos:
NeutralizaciónEs una reacción instantánea y altamente exotérmica, como se ha visto anteriormente, con un producto de reacción inestable pero podemos obtener una buena realización industrial cuando se dan las siguientes condiciones:
La temperatura de reacción se controla por medio de la debida regulación de la adicción de los reactivos, por extracción del calor generado y en casos extremos, añadiendo agua (condensados) al contenido del neutralizador. Si bien pueden eliminarse prácticamente las pérdidas del ácido sólo por medio del control de la temperatura de reacción, no ocurre lo mismo con las pérdidas de amoniaco, debido a su mayor volatilidad. Por esto, es necesario tomar medidas adicionales. En algunos procesos se añade, para este propósito un ligero exceso de ácido sobre la cantidad estequiométricamente requerida. En otros, el neutralizador funciona totalmente lleno de líquido, lo cual hace factible, mantener en él una presión de varias atmósferas, muy por encima de la presión de vapor de la solución. En la práctica los procesos comerciales difieren en dos puntos principales, en la mezcla y en le control de la temperatura, siendo ésta la característica más importante. Los parámetros de la reacción y la construcción adoptada en la neutralización definen toda una línea de producción: ácido precalentado, evaporación de amoniaco y evaporación del agua restante (parcial o totalmente) puede ser realizados mediante el calor recuperado en la neutralización. Tipos de neutralizadoresSegún la temperatura de la zona de reacciónSe dividen los neutralizadores en tres grupos de acuerdo con la temperatura de la zona de reacción, los cuales pueden trabajar:
Neutralizadores que trabajan por debajo del punto de ebullición atmosférico, son métodos de baja temperatura y presentan ventajas tales como:
También tienen algunos inconvenientes, como:
Neutralizadores que trabajan en el punto de ebullición atmosférico, no utilizan recirculación de la solución de nitrato amónico, por lo tanto la reacción estará menos controlada al ser muy exotérmica y brusca, si se recircula la solución ésta absorbe parte del calor y se controla esta brusquedad, evitándose las pérdidas de nitrógeno que podrían originarse. Aunque su temperatura es mayor que la de los neutralizadores anteriores, en torno a 150 y 200 °C, presenta ventajas como:
El inconveniente principal es la contaminación del vapor de proceso con amoniaco y ácido nítrico, con lo que se necesitan equipos de acero inoxidable. Los neutralizadores sobre el punto de ebullición atmosférico son los más adecuados para un buen proceso de producción. Los neutralizadores que trabajan sobre el punto de ebullición atmosférico, la característica común de todo diseño en este grupo es que la presión aplicada generalmente entre 2 y 6 bar se emplea para levantar la temperatura en el neutralizador hasta 180 °C aproximadamente. A presiones y temperaturas más elevadas se causan mayores pérdidas y más corrosión, siendo necesarios equipos especiales. De acuerdo con la recuperación de calor de reacciónSe distinguen los siguientes tipos de neutralizadores:
Los dos primeros casos no se usan en plantas modernas, es decir, por lo menos una parte de los vapores producidos son utilizados en procesos de la misma planta. Según la presión de los vapores producidos en el neutralizadorComo el factor determinante en la recuperación de calor es el neutralizador, las condiciones de operación del neutralizador definirán la presión de los vapores en el mismo y por tanto su temperatura de condensación, que es el parámetro usado en la anterior clasificación. Por lo tanto parece más apropiado agrupar los procesos de acuerdo con la presión de los vapores producidos en el neutralizador, así existirán:
Tipos de neutralizacionesNeutralización a presión inferior a la atmosférica (a vacío)En este tipo de neutralizadores, cuando el amoniaco y el ácido nítrico reaccionan, el calor de reacción comienza a aumentar incrementando la temperatura de la mezcla hacia su punto de ebullición, donde comenzará la evaporación y la temperatura seguirá su incremento hasta el punto donde el agua presente, se evapore consumiendo el calor de la reacción sobrante del calentamiento de la mezcla. Para trabajar en torno a este punto, todos los procesos utilizan sistemas de recirculación, donde una parte del nitrato amónico producido se enfría y es recirculado al neutralizador, provocando así un control más fino de la temperatura en el neutralizador. Dicho enfriamiento y la relación de recirculación definirán la temperatura en el neutralizador. Este tipo de neutralizadores mantiene la temperatura en torno a 100 y 120 °C, pero se hace necesario utilizar el calor de la reacción para evaporar una parte del agua contenida en el producto, es decir, se obtienen concentraciones bajas de productos. Este tipo de neutralizadores suelen ser del tipo neutralizadores vacuum flash o a vacío, pudiéndose llevar a cabo en una o varias etapas, así se pueden distinguir:
Ventajas e inconvenientes de la neutralización a vacío
Neutralización a presión atmosféricaEstos equipos son más simples que los anteriores, trabajan a mayores temperaturas (en torno a los 150 y 200 °C) producirán una corriente de vapor que contendrá la mayor parte del agua introducido por el ácido nítrico, que se utilizará para el precalentamiento de las materias primas. Con concentraciones de ácido nítrico en torno al 60% w se pueden lograr concentraciones en torno al 98% w de nitrato amónico, aunque se suele utilizar un pequeño evaporador posteriormente al neutralizador. Para lograr un mejor control de pH se usan dos neutralizadores en serie, siendo el segundo más pequeño que el primero, para lograr un ajuste más fino. Ventajas e inconvenientes de la neutralización a presión atmosférica
Neutralización a sobrepresiónSe pueden distinguir dos tipos de procesos a sobrepresión:
Se suelen llevar a cabo entre 4 y 6 atm, dependiendo del proceso industrial. La presión sirve para aumentar la temperatura en el mismo alrededor de los 200 °C. Dentro de este grupo se pueden mostrar los procesos Fauser y Stengel. Ventajas e inconvenientes de la neutralización a sobrepresión
EvaporaciónLos distintos procedimientos difieren el contenido en agua de los reactivos (por lo tanto de la concentración de nitrato amónico que salga de la sección de neutralización), de la cantidad de agua requerida en los siguientes procesos de solidificación del producto final y del control de las temperaturas. En los métodos utilizados hasta 1945, la solución neutralizada de nitrato de amonio sufría una evaporación hasta una concentración elevada, seguida de un enfriamiento consecutivo y la formación del producto. Otros métodos realizaban la evaporación hasta una menor concentración y completaban la misma mediante cristalización o evaporación continua en aparatos diseñados a tal efecto, dicha evaporación también se hacía mediante evaporadores de película (wiped film) que tenían la ventaja de contener pesos muy bajos de materia en tratamiento. Después de 1965, eficaces evaporadores que operan al vacío se han utilizado en nuevas fábricas, estas modernas unidades tienen una mayor eficiencia térmica y pueden controlarse con precisión. La parte de la unidad donde la concentración es mayor al 99% w de nitrato amónico, es diseñada para retener únicamente pequeñas cantidades de solución concentrada por cuestiones de seguridad. Estas precauciones son necesarias parra evitar la contaminación de la solución por materias orgánicas y su posible explosión. Las soluciones de nitrato amónico pueden variar entre el 78 y 98% w, y los procesos de solidificación pueden trabajar con melazas desde el 5% w de agua (en los granuladores de tambor) hasta de 0,3 a 0,5% w de agua (en torres prilling), por ello que en la industria existan cientos de evaporadores, cada uno ajustado lo más posible a las necesidades impuestas por el producto requerido. Manejo y almacenamiento
Medidas de seguridad
Información sobre el transporte
Referencias
Véase tambiénEnlaces externos
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Nitrato_de_amonio publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


Enciclopedia