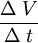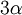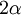|
La termodinámica (del griego θερμo-, termo, que significa "calor" [1] y δύναμις, dinámico, que significa "fuerza" [2] ) es una rama de la física que estudia los efectos de los cambios de la temperatura, presión y volumen de los sistemas físicos a un nivel macroscópico. Aproximadamente, calor significa "energía en tránsito" y dinámica se refiere al "movimiento", por lo que, en esencia, la termodinámica estudia la circulación de la energía y cómo la energía infunde movimiento. Históricamente, la termodinámica se desarrolló a partir de la necesidad de aumentar la eficiencia de las primeras máquinas de vapor. El punto de partida para la mayor parte de las consideraciones termodinámicas son las leyes de la termodinámica, que postulan que la energía puede ser intercambiada entre sistemas físicos en forma de calor o trabajo. También se postula la existencia de una magnitud llamada entropía, que puede ser definida para cualquier sistema. En la termodinámica se estudian y clasifican las interacciones entre diversos sistemas, lo que lleva a definir conceptos como sistema termodinámico y su contorno. Un sistema termodinámico se caracteriza por sus propiedades, relacionadas entre sí mediante las ecuaciones de estado. Éstas se pueden combinar para expresar la energía interna y los potenciales termodinámicos, útiles para determinar las condiciones de equilibrio entre sistemas y los procesos espontáneos. Con estas herramientas, la termodinámica describe cómo los sistemas responden a los cambios en su entorno. Esto se puede aplicar a una amplia variedad de temas de ciencia e ingeniería, tales como motores, transiciones de fase, reacciones químicas, fenómenos de transporte, e incluso agujeros negros. Los resultados de la termodinámica son esenciales para otros campos de la física y la química, ingeniería química, ingeniería aeroespacial, ingeniería mecánica, biología celular, ingeniería biomédica, y la ciencia de materiales por nombrar algunos.
Conocimientos adicionales recomendados
Leyes de la termodinámicaPrimera ley de la termodinámicaTambién conocido como principio de conservación de la energía para la termodinámica, establece que si se realiza trabajo sobre un sistema o bien éste intercambia calor con otro, la energía interna del sistema cambiará. Visto de otra forma, esta ley permite definir el calor como la energía necesaria que debe intercambiar el sistema para compensar las diferencias entre trabajo y energía interna. Fue propuesta por Antoine Lavoisier. La ecuación general de la conservación de la energía es la siguiente: Que aplicada a la termodinámica teniendo en cuenta el criterio de signos termodinámico, queda de la forma: 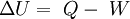 Segunda ley de la termodinámicaEsta ley regula la dirección en la que deben llevarse a cabo los procesos termodinámicos y, por lo tanto, la imposibilidad de que ocurran en el sentido contrario (por ejemplo, que una mancha de tinta dispersada en el agua pueda volver a concentrase en un pequeño volumen). También establece, en algunos casos, la imposibilidad de convertir completamente toda la energía de un tipo en otro sin pérdidas. De esta forma, La Segunda ley impone restricciones para las transferencias de energía que hipotéticamente pudieran llevarse a cabo teniendo en cuenta sólo el Primer Principio. Esta ley apoya todo su contenido aceptando la existencia de una magnitud física llamada entropía tal que, para un sistema aislado (que no intercambia materia ni energía con su entorno), la variación de la entropía siempre debe ser mayor que cero. Debido a esta ley también se tiene que el flujo espontáneo de calor siempre es unidireccional, desde los cuerpos a temperatura más alta a aquellos de temperatura más baja. Existen numerosos enunciados equivalentes para definir este principio, destacándose el de Clausius y el de Kelvin. Enunciado de ClausiusEn palabras de Sears es: " No es posible ningún proceso cuyo único resultado sea la extracción de calor de un recipiente a una cierta temperatura y la absorción de una cantidad igual de calor por un recipiente a temperatura más elevada". Enunciado de KelvinNo existe ningún dispositivo que, operando por ciclos, absorba calor de una única fuente y lo convierta íntegramente en trabajo. Otra interpretaciónEs imposible construir una máquina térmica cíclica que transforme calor en trabajo sin aumentar la energía termodinámica del ambiente. Debido a esto podemos concluir que el rendimiento energético de una máquina térmica cíclica que convierte calor en trabajo siempre será menor a la unidad y ésta estará más próxima a la unidad cuanto mayor sea el rendimiento energético de la misma. Es decir, mientras mayor sea el rendimiento energético de una máquina térmica, menor será el impacto en el ambiente, y viceversa. Tercera ley de la termodinámicaLa Tercera de las leyes de la termodinámica, propuesto por Walther Nernst, afirma que es imposible alcanzar una temperatura igual al cero absoluto mediante un número finito de procesos físicos. Puede formularse también como que a medida que un sistema dado se aproxima al cero absoluto, su entropía tiende a un valor constante específico. La entropía de los sólidos cristalinos puros puede considerarse cero bajo temperaturas iguales al cero absoluto. No es una noción exigida por la Termodinámica clásica, así que es probablemente inapropiado tratarlo de “ley”. Es importante recordar que los principios o leyes de la Termodinámica son sólo generalizaciones estadísticas, válidas siempre para los sistemas macroscópicos, pero inaplicables a nivel cuántico. El demonio de Maxwell ejemplifica cómo puede concebirse un sistema cuántico que rompa las leyes de la Termodinámica. Asimismo, cabe destacar que el primer principio, el de conservación de la energía, es la más sólida y universal de las leyes de la naturaleza descubiertas hasta ahora por la ciencia. Ley cero de la termodinámicaEl equilibrio termodinámico de un sistema se define como la condición del mismo en el cual las variables empíricas usadas para definir un estado del sistema (presión, volumen, campo eléctrico, polarización, magnetización, tensión lineal, tensión superficial, entre otras) no son dependientes del tiempo. A dichas variables empíricas (experimentales) de un sistema se les conoce como coordenadas termodinámicas del sistema. A este principio se le llama del equilibrio termodinámico. Si dos sistemas A y B están en equilibrio termodinámico, y B está en equilibrio termodinámico con un tercer sistema C, entonces A y C están a su vez en equilibrio termodinámico. Este principio es fundamental, aun siendo ampliamente aceptado, no fue formulado formalmente hasta después de haberse enunciado las otras tres leyes. De ahí que recibe la posición 0. TermometríaLa termometría se encarga de la medición de la temperatura de cuerpos o sistemas. Para este fin, se utiliza el termómetro, que es un instrumento que se basa en el cambio de alguna propiedad de la materia debido al efecto del calor; así se tiene el termómetro de mercurio y de alcohol, que se basan en la dilatación, los termopares que deben su funcinamiento al cambio de la conductividad eléctrica, los ópticos que detectan la variación de la intensidad del rayo emitido cuando se refleja en un cuerpo caliente.
Demostración de la existencia de la temperatura empírica de un sistema en base a la ley ceroPara dos sistemas en equilibrio termodinámico representados por sus respectivas coordenadas termodinámicas (X1,Y1) y (X2,Y2) tenemos que dichas coordenadas no son función del tiempo, por lo tanto es posible hallar una función que relacionem dichas coordenadas, es decir: Sean tres sistemas hidrostáticos, A,B,C, representados por sus respectivas termodinámicas: (Pa,Va), (Pb,Vb),(Pc,Vc). Si A y C están en equilibrio debe existir una función tal que: Es decir: Donde las funciones f1 y g1 dependen de la naturaleza de los fluidos. Análogamente, para el equilibrio de los fluidos B y C:
Es decir: Con las mismas considerciones que las funciones f2 y g2 dependen de la naturaleza de los fluidos. La condición dada por la ley cero de la termodinámica de que el equilibrio térmico de A con C y de B con C implica asimismo el quilibrio de A y B puede expresarse matemáticamente como:
Lo nos conduce a la siguiente expresión:
Entonces, llegamos a la conclusión de que las funciones g1 y g2 deben ser de naturaleza tal que se permita la eliminación de la variable termodinámica comón Vc. Una posibilidad, que puede demostrarse única, es: Asimismo: Una vez canceladas todas las partes que contienen a Vc podemos escribir: Mediante una simple repetición del argumento, tenemos que: Y así sucesivamente para cualquier número de sistemas en equilibrio termodinámico. Henos demostrado que para todos los sistemas que se hallen en equilibrio termodinámico entre si, existen sendas funciones cuyos valores numéricos son iguales para cada uno de dichos sistemas en equlibrio. Este valor numérico puede ser representado con la letra griega θ y será definido como la temperatura empírica de los sistemas en equilibrio termodinámico. Así, tenemos que todo equilibrio termodinámico entre dos sistemas es equivalente a un equilibrio térmico de los mismos, es decir, a una igualdad de temperaturas empíricas de estos. Propiedades termométricasUna propiedad termométrica de una sustancia es aquella que varía en el mismo sentido que la temperatura, es decir, si la temperatura aumenta su valor, la propiedad también lo hará, y viceversa. Escalas de temperaturaLo que se necesita para construir un termómetro son puntos fijos, es decir, procesos en los cuales la temperatura permanece constante. Ejemplos de procesos de este tipo son el proceso de ebullición y el proceso de fusión. Los puntos generalmente utilizados son el proceso de ebullición y de solidificación de alguna sustancia, durante los cuales la temperatura permanece constante. Existen varias escalas para medir temperaturas, las más importantes son la escala Celsius, la escala Kelvin y la escala Fahrenheit. Escala CelsiusPara esta escala, se toman como puntos fijos, los puntos de ebullición y de solidificación del agua, a los cuales se les asignan los valores de 100 y 0 respectivamente. En esta escala, estos valores se escriben como 100° y 0°. Esta unidad de medida se lee grado Celsius y se denota por [°C]. El grado Celsius, representado como °C, es la unidad creada por Anders Celsius para su escala de temperatura. Se tomó como base para el Kelvin y es la unidad de temperatura más utilizada internacionalmente. A partir de su creación en 1750 fue denominado grado centígrado (se escribía °c, en minúscula). Pero en 1948 se decidió el cambio en la denominación oficial para evitar confusiones con la unidad de ángulo también denominada grado centígrado (grado geométrico), aunque la denominación previa se sigue empleando extensamente en el uso coloquial. Hasta 1954 se definió asignando el valor 0 a la temperatura de congelación del agua, el valor 100 a la de temperatura de ebullición —ambas medidas a una atmósfera de presión— y dividiendo la escala resultante en 100 partes iguales, cada una de ellas definida como 1 grado. Estos valores de referencia son muy aproximados pero no correctos por lo que, a partir de 1954, se define asignando el valor 0,01 °C a la temperatura del punto triple del agua y definiendo 1 °C como la fracción 1/273,16 de la diferencia con el cero absoluto. Conversión de unidades [editar] La magnitud de un grado Celsius (1 °C) es equivalente a la magnitud de un Kelvin (1 K), puesto que esta unidad se define como igual a la primera. Sin embargo, las escalas son diferentes porque la escala Kelvin toma como valor 0 el cero absoluto. Dado que al cero absoluto corresponde un valor de -273,15 °C, la temperatura expresada en °C y K difiere en 273,15 unidades: • La conversión de grados Celsius a grados Fahrenheit se obtiene multiplicando la temperatura en Celsius por 1,8 (9/5) y sumando 32: • Para convertir Fahrenheit a Celsius: • Escala Kelvin o absolutaEn este caso, la escala fue establecida en base a la escala Celsius, donde el valor de 0° corresponde al cero absoluto, temperatura en la cual las moléculas y átomos de un sistema tienen la mínima energía térmica posible. Ningún sistema macroscópico puede tener una temperatura inferior. En escala Celsius esta temperatura corresponde a -273°C. Esta unidad de medida se lee Kelvin y se denota por [K]. Esta unidad se llama también Escala Absoluta y es también la unidad adoptada por el Sistema Internacional de Unidades. Dado que 0[K] corresponden a -273[°C], se puede hallar una fórmula de conversión, entre la escala Celsius y la escala Kelvin, de la siguiente forma:
donde la letra T representa la temperatura en Kelvin y la letra tc representa la temperatura en grados Celsius. Escala FahrenheitEn esta escala también se utilizaron puntos fijos para construirla, pero en este caso fueron los puntos de solidificación y de ebullición del cloruro amónico en agua. Estos puntos se marcaron con los valores de 0 y 100 respectivamente. La unidad de esta escala se llama grado Fahrenheit y se denota por [°F]. Dado que en escala Celsius, los valores de 0[°C] y 100[°C] corresponden respectivamente a 32[°F] y 212[°F] respectivamente, la fórmula de conversión de grados Celsius a Fahrenheit es:
aquí el símbolo tf representa la temperatura en grados Fahrenheit y el símbolo tc representa la temperatura en grados Celsius.
Sistema y ambienteEn el estudio de la Termodinámica la atención está dirigida al interior de un sistema, aunque se adopte un punto de vista macroscópico, sólo se consideran aquellas magnitudes de este tipo que tienen relación con el estado interno del sistema. Para poder entender las magnitudes involucradas en este tema, se hace necesario definir los conceptos de sistema y estado de un sistema. SistemaSe puede definir un sistema como un conjunto de materia, que está limitado por una superficie, que le pone el observador, real o imaginaria. Si en el sistema no entra ni sale materia, se dice que se trata de un sistema cerrado, o sistema aislado si no hay intercambio de materia y energía, dependiendo del caso. En la naturaleza, encontrar un sistema extrictamente aislado es, por lo que sabemos, imposible, pero podemos hacer aproximaciones. Un sistema del que sale y/o entra materia, recibe el nombre de abierto. Ponemos unos ejemplos:
Medio externoSe llama medio externo o ambiente a todo aquello que no está en el sistema pero que puede influir en él. Por ejemplo, consideremos una taza con agua, que está siendo calentada por un mechero. Consideremos un sistema formado por la taza y el agua, entonces el medio está formado por el mechero, el aire, etc. Equilibrio térmicoToda sustancia por encima de los 0º Kelvin (-273.15º Centígrados)emite calor. Si 2 sustancias en contacto se encuentran a diferente temperatura, una de ellas emitirá más calor y calentará a la más fría. El equilibrio térmico se alcanza cuando ambas emiten, y reciben la misma cantidad de calor, lo que iguala su temperatura.
Variables termodinámicasLas variables que tienen relación con el estado interno de un sistema, se llaman variables termodinámicas o coordenadas termodinámicas, y entre ellas las más importantes en el estudio de la termodinámica son:
Estado de un sistemaUn sistema que puede describirse en función de coordenadas termodinámicas se llama sistema termodinámico y la situación en la que se encuentra definido por dichas coordenadas se llama estado del sistema. Equilibrio térmicoUn estado en el cual dos coordenadas termodinámicas independientes X e Y permanecen constantes mientras no se modifican las condiciones externas se dice que se encuentra en equilibrio térmico. Si dos sistemas se encuentran en equilibrio térmico se dice que tienen la misma temperatura. Entonces se puede definir la temperatura como una propiedad que permite determinar si un sistema se encuentra o no en equilibrio térmico con otro sistema. El equilibrio térmico se presenta cuando dos cuerpos con temperaturas diferentes se ponen en contacto, y el que tiene mayor temperatura cede calor al que tiene mas baja, hasta que ambos alcanzan la misma temperatura. Algunas definiciones útiles en termodinámica son las siguientes. Foco térmicoUn foco térmico es un sistema que puede entregar y/o recibir calor, pero sin cambiar su temperatura. Contacto térmicoSe dice que dos sistema están en contacto térmico cuando puede haber transferencia de calor de un sistema a otro. Procesos termodinámicosSe dice que un sistema pasa por un proceso termodinámico, o transformación termodinámica, cuando al menos una de las coordenadas termodinámicas no cambia. Los procesos más importantes son:
Por ejemplo, dentro de un termo donde se echan agua caliente y cubos de hielo, ocurre un proceso adiabático, ya que el agua caliente se empezará a enfriar debido al hielo, y al mismo tiempo el hielo se empezará a derretir hasta que ambos estén en equilibrio térmico, sin embargo no hubo transferencia de calor del exterior del termo al interior por lo que se trata de un proceso adiabático. Rendimiento termodinámico o eficienciaUn concepto importante en la ingeniería térmica es el de rendimiento. El rendimiento de una máquina térmica se define como:
donde, dependiendo del tipo de máquina térmica, estas energías serán el calor o el trabajo que se transfieran en determinados subsistemas de la máquina. Teorema de CarnotNicolas Léonard Sadi Carnot en 1824 demostró que el rendimiento de alguna máquina térmica que tuviese la máxima eficiencia posible (a las que en la actualidad se denotan con su nombre) y que operase entre dos termostatos (focos con temperatura constante), dependería sólo de las temperaturas de dichos focos. Por ejemplo, el rendimiento para un motor térmico de Carnot viene dado por:
donde Tc y Th son las temperaturas del termostato frío y del termostato caliente, respectivamente, medidas en Kelvin. Este rendimiento máximo es el correspondiente al de una máquina térmica reversible, la cual es sólo una idealización, por lo que cualquier máquina térmica construida tendrá un rendimiento menor que el de una máquina reversible operando entre los mismos focos.
Dilatación térmicaLa dilatación térmica corresponde al efecto de que las sustancias se "agrandan" al aumentar la temperatura. En objetos sólidos, la dilatación térmica produce un cambio en las dimensiones lineales de un cuerpo, mientras que en el caso de líquidos y gases, que no tienen forma permanente, la dilatación térmica se manifiesta en un cambio en su volumen. Dilatación linealConsideremos primero la dilatación térmica de un objeto sólido, cuyas dimensiones lineales se pueden representar por l0 , y que se dilata en una cantidad ΔL. Experimentalmente se ha encontrado que para casi todas las sustancias y dentro de los límites de variación normales de la temperatura, la dilatación lineal ΔL es directamente proporcional al tamaño inicial l0 y al cambio en la temperatura Δt, es decir:
donde Dilatación superficialEs el mismo concepto que el de dilatación lineal salvo que se aplica a cuerpos a los que es aceptable y preferible considerarl como regiones planas; por ejemplo, una plancha metálica. Al serle transmitida cierta cantidad de calor la supeperficie del objeto sufrirá un incremento de área: ΔA.
Dilatación volumétricaLa dilatación térmica de un líquido o un gas se observa como un cambio de volumen ΔV en una cantidad de sustancia de volumen V0, relacionado con un cambio de temperatura Δt. En este caso, la variación de volumen ΔV es directamente proporcional al volumen inicial V0 y al cambio de temperatura Δt, para la mayor parte de las sustancias y dentro de los límites de variación normalmente accesibles de la temperatura, es decir:
Se puede demostrar fácilmente usando el álgebra que: Análogamente se puede obtener el coeficiente de dilatación superficial γ dado por: Diagramas termodinámicosReferenciasVéase también
Enlaces externosbe-x-old:Тэрмадынаміка Categoría: Termodinámica |
|
| Este articulo se basa en el articulo Termodinámica publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




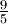 tc + 32°
tc + 32°
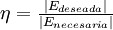
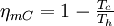
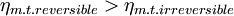
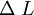 =
= 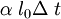
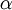 =
= 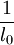 .
.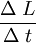
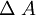 =
= 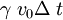
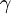 =
=  .
.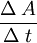
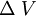 =
= 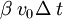
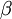 =
=