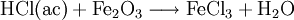|
El cloruro férrico (también llamado cloruro de hierro (III), o equívocamente percloruro de hierro) es un cloruro de hierro (III), de fórmula FeCl3. En su forma cristalina tiene una apariencia brillante de color verde oscuro, aunque su color depende del ángulo de iluminación. Conocimientos adicionales recomendados
DisolucionesEn disolución alcohólica se lo conoce como tintura de hierro. Obtención
ReaccionesEl cloruro de hierro (III) es un ácido de Lewis moderadamente fuerte, formando aductos con bases de Lewis tales como óxido de trifenilfosfina: FeCl3(OPPh3)2 donde Ph = fenil = C6H5- Reacciona con otros cloruros para dar el ión tetraédrico FeCl4−, de color amarillo. Calentado con óxido de hierro (III) a 350 °C, se transforma en oxicloruro de hierro (III):
En medio básico, reacciona con alcoholes para dar complejos dímeros de alcóxidos : Los oxalatos reaccionan rápidamente con el cloruro de hierro (III) disuelto para dar [Fe(C2O4)3]3−. El cloruro de hierro (III) es un oxidante suave, capaz de oxidar el cloruro de cobre (I) a cloruro de cobre (II). Agentes reductores como hidrazina convierten el cloruro de hierro (III) en complejos de hierro (II). AplicacionesIndustrialesSe utiliza para depurar las aguas residuales y para tratamiento de agua de consumo.[2] FeCl3 en medio acuoso ligeramente básico reacciona con el ión hidróxido para formar flóculos de FeO(OH)-, que puede eliminar los materiales en suspensión.
Otro uso importante del FeCl3 es para grabar o decapar el cobre en una reacción redox que oxida el cobre a cloruro de cobre (I) y luego a cloruro de cobre (II) en la producción de circuito impreso.[3]
El cloruro de hierro (III) se usa como catalizador de la reacción de adición de etileno con cloro, formando (1,2-dicloroetano), una materia prima importante para producir industrialmente cloruro de vinilo , el monómero para fabricar PVC.
De laboratorioEl cloruro de hierro (III) se usa en el laboratorio como ácido de Lewis para reacciones de catálisis tales como cloración y reacción de Friedel-Crafts de compuestos aromáticos. Es menos potente que cloruro de aluminio, pero esta menor fortaleza conduce a veces a rendimientos más altos, como en la alquilación de benceno:
La "prueba del cloruro férrico" es una prueba colorimétrica tradicional para fenoles, que usa una disolución al 1% de cloruro de hierro (III) que ha sido neutralizada con hydróxido sódico hasta que se forme un leve precipitadeo de FeO(OH).[4] La mezcla se filtra antes de ser usada. La sustancia orgánica se disuelve en agua, metanol or etanol, luego se añade la disolución neutra de cloruro: —una coloración transitoria o permanente (normalmente púrpura, verde o azul) indica la presencia de un fenol o enol. Uso en ElectrónicaUna de sus más importantes aplicaciones es en electrónica para producir placas de circuito impreso en bajas cantidades. El cloruro férrico reacciona con el cobre dando cloruro ferroso y cloruro cúprico como lo muestra la siguiente reacción rédox.
Hay dos procedimientos para esto. Uno consiste en realizar un dibujo manualmente sobre una plaqueta con una cara de cobre, mediante el uso de un rotulador permanente resistente al ataque de ácidos. También suelen aplicarse diversos métodos más efectivos reemplazando el uso del rotulador, como es el empleo de fóleos de acetato (también conocidos como "Transparencias"), imprimiendo sobre este la imagen del circuito prediseñado en un ordenador. Para este método es conveniente utilizar impresoras laser o fotocopiadoras, ya que contienen Tóner, y este es resistente al ataque ácido. Una vez impreso el circuito en el acetato, se procede a calentar el cobre de la placa (mediante el uso de una plancha o similar) para posteriormente colocar el acetato sobre ella y adherir el Tóner a él. Para finalizar se introduce la placa en la solución de cloruro férrico. El otro método, con resultados de mayor calidad, se basa en el empleo de plaquetas sensibles a la luz. Se cubre la plaqueta con una transparencia (acetato) con el circuito impreso, luego se deja a disposición de una fuente de rayos UV. Y al finalizar este proceso se lo sumerge casi instantáneamente en un revelador y luego en la solución de cloruro férrico. Para el primer procedimiento se utilizan placas con capa de cobre comunes, mientras que para el segundo se utilizan placas fotosensibilizadas. De preferencia se calienta la solución a 25 °C previamente, o simultáneamente a través de un baño calefactor. La plaqueta debería flotar sobre la solución si ésta se encuentra en buen estado. Es altamente recomendable, aunque no obligatorio, utilizar una fuente de aire en el recipiente donde vaya la solución, de esta manera se oxigena y el ataque del Cloruro Férrico es más efectivo, además de ayudar a eliminar el residuo de cobre de la placa. Otros usosEl cloruro de hierro (III) anhidro se usa a veces como reactivo deshidratante en ciertas reacciones. Lo usan los fabricantes de cuchillos y espadas artesanales para teñir las hojas y para dar un efecto de contraste al metal y para ver las imperfecciones del metal. También se usa para el fotograbado de láminas de cobre para imprimir imágenes fotográficas al aguafuerte o por intaglio y para grabar los cilindros de rotograbado usados en la industria de artes gráficas. PrecaucionesEl cloruro de hierro (III) es tóxico, ácido y muy corrosivo. El material anhidro es un poderoso agente deshidratante. En las escuelas de Secundaria donde se enseña Diseño o Tecnología, las disoluciones de cloruro férrico se usan para grabar las placas de circuito impreso. Es importante lavar inmediatamente las manos y otras superficies que hayan estado en contacto con la disolución para evitar daños.
Categoría: Cloruros |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Cloruro_de_hierro_(III) publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


Enciclopedia