|
Moléculas o compuestos diatómicos (del griego δι, dos y άτομον, átomo) son aquellos que están formados por dos átomos del mismo elemento químico. Aunque el prefijo di sólo significa dos, normalmente se sobreentiende que la molécula tiene dos átomos del mismo elemento. Conocimientos adicionales recomendados
Descripción y localización en la naturalezaEl libro de Huber y Gerhard Herzberg, Molecular Spectra and Molecular Structure IV. Constants of Diatomic Molecules[1] (Wikipedia en inglés), lista cientos de moléculas diatómicas, algunas de las cuales se han detectado espectroscópicamente en el espacio interestelar. No obstante, de todas estas, sólo algunas se encuentran en la naturaleza aunque representan casi la totalidad de la atmósfera terrestre: dinitrógeno (78%), dioxígeno (21%), argón (0.9340%). El oxígeno también aparece en forma de molécula triatómica con el nombre de ozono (O3). Elementos diatómicos son aquellos que prácticamente existen exclusivamente como moléculas diatómicas, son conocidas como moléculas diatómicas homonucleares cuando en su estado natural no están químicamente enlazados con otro elemento. Entre los ejemplos más comunes encontramos el H2 y el O2. Lista de elementos diatómicos: -Hidrógeno H2 -Oxígeno O2 -Nitrógeno N2 -Cloro Cl2 -Flúor F2 -Bromo Br2 -Yodo I2
Si un compuesto está formado por átomos del mismo elemento como el hidrógeno o el oxígeno se dice que son homonucleares. Si no es así, como el óxido de carbono (II) o el óxido de nitrógeno (II), se dice que son heteronucleares. Aun así casi siempre entendemos por moléculas diatómicas a las homonucleares. El enlace químico en una molécula diatómica homonuclear es apolar y covalente. Otros elementos existen con forma diatómica pero con una alta inestabilidad y reactividad. Como ejemplo tendríamos el difósforo (P2). Significación históricaDurante el siglo XIX se pensaba que los compuestos podían ser diatómicos pero no se había confirmado. De hecho, John Dalton dijo en su teoría atómica que los átomos eran monoatómicos y que los átomos de los compuestos tenían el mismo radio atómico. Por ejemplo, Dalton pensó que la fórmula del agua era HO. En consecuencia de esto se realizaron cálculos erróneos sobre la masa y peso de algunos compuestos básicos. En 1805, Gay-Lussac y von Humboldt mostraron que el agua estaba formada por dos hidrógenos y un oxígeno. En 1811, Amedeo Avogadro concretó la exacta composición del agua, basándose en lo que hoy se conoce como Ley de Avogadro y la evidencia de la existencia de moléculas diatómicas. No obstante, estos resultados fueron ignorados en su mayor parte hasta 1860. Esto fue, en parte, por la afirmación de Avogadro al decir que los átomos de un elemento no tenían ninguna afinidad electrónica hacia átomos del mismo elemento. Además, algunos conceptos de la disociación de moléculas no estaban explicados en la Ley de Avogadro. En 1860, en el Congreso de Karlsruhe sobre masas y pesos atómicos, Cannizzaro revivió las ideas de Avogadro y las usó para realizar una tabla periódica de pesos atómicos, que tenían bastante similitud con los actuales valores. Estos pesos fueron un importante pre-requisito para el descubrimiento de la Ley Periódica de Dmitri Mendeleev y Lothar Meyer. Niveles energéticosEs muy común, y conveniente, representar las moléculas diatómicas como dos masas puntuales (los dos átomos). Las energías encargadas en el movimiento de la molécula pueden clasificarse en tres categorías:
Energías translacionalesLa energía translacional de una molécula es dada simplemente por la ecuación de la energía cinética: donde “m” es la masa de la molécula y “v” es su velocidad. Energías rotacionalesLa energía cinética de rotación es:
Microscópicamente, en los sistemas de nivel atómico como una molécula, el momento angular sólo puede tener valores específicos dados por: donde “l” un número natural y También, el momento de inercia de una molécula es:
Es decir, substituyendo el momento angular y el momento de inercia en Erot, los niveles de energía rotacional en una molécula diatómica están dadas por: Energías vibracionalesOtra manera por la cual una molécula diatómica puede moverse es teniendo cada oscilación de cada átomo - o vibración - a lo largo de una línea (enlace) conectando ambos átomos. donde:
Comparación entre las energías rotacionales y vibracionalesEl nivel de energía rotacional más bajo de una molécula diatómica se da con: l = 0 y da Erot = 0. Para el O2, el siguiente nivel cuántico más alto (l = 1) tiene una energía aproximada de: Este espaciamiento entre los más bajos niveles de energía rotacional de O2 es comparable a un fotón en una región de microondas del espectro electromagnético. El nivel más bajo de energía vibracional es dado por: n = 0, y una típica frecuencia de vibración es 5 x 1013 Hz. Haciendo un cálculo parecido a este último se obtiene:
Entonces, el espaciamiento y la energía de una típica transición espectroscópica, entre los niveles de energía vibracional es aproximadamente 100 veces mayor que una típica transición entre los niveles de energía rotacional. Referencias
|
|||||||
| Este articulo se basa en el articulo Moléculas_diatómicas publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. |


Enciclopedia




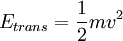
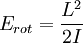
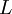 es el
es el 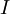 es el momento de inercia de la molécula.
es el momento de inercia de la molécula.
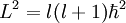
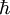 es la constante reducida de Planck.
es la constante reducida de Planck.
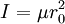
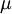 es la masa reducida de la molécula.
es la masa reducida de la molécula.
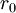 es la distancia media entre los dos átomos de la molécula.
es la distancia media entre los dos átomos de la molécula.
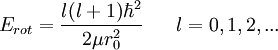
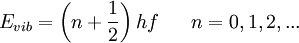
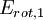
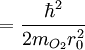
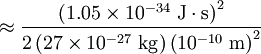
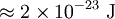
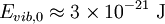 .
.
