Historia de la mecánica cuántica
La historia de la mecánica cuántica entrelazada con la historia de la química cuántica comienza escencialmente con el descubrimiento de los rayos catódicos en 1838 realizado por Michael Faraday, la introducción del término cuerpo negro por Gustav Kirchhoff en el invierno de 1859-1860, la sugerencia hecha por Ludwig Boltzmann en 1877 sobre que los estados de energía de un sistema físico deberían ser discretos, y la hipótesis cuántica de Max Planck en el 1900, quien decía que cualquier sistema de radiación de energía atómica podía teóricamente ser dividido en un número de elementos de energía discretos 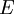 , tal que cada uno de estos elementos de energía sea proporcional a la frecuencia , tal que cada uno de estos elementos de energía sea proporcional a la frecuencia 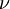 , con las que cada uno podía de manera individual irradiar energía,
como lo muestra la siguiente fórmula: , con las que cada uno podía de manera individual irradiar energía,
como lo muestra la siguiente fórmula: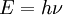
donde 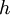 es un valor numérico llamado constante de Planck. Entonces, en 1905, para explicar el efecto fotoeléctrico (1839), esto es, que la luz brillante en ciertos materiales puede funcionar para expulsar electrones del material, Albert Einstein postuló basado en la hipótesis cuántica de Planck, que la luz en sí está compuesta de partículas cuánticas individuales, las cuales más tarde fueron llamadas fotones (1926). La frase "mecánica cuántica" fue usada por primera vez en el paper de Max Born llamado Zur Quantenmechanik (La Mecánica Cuántica). En los años que siguen, esta base teórica lentamente comenzó a ser aplicada a estructuras, reacciones y enlaces químicos. es un valor numérico llamado constante de Planck. Entonces, en 1905, para explicar el efecto fotoeléctrico (1839), esto es, que la luz brillante en ciertos materiales puede funcionar para expulsar electrones del material, Albert Einstein postuló basado en la hipótesis cuántica de Planck, que la luz en sí está compuesta de partículas cuánticas individuales, las cuales más tarde fueron llamadas fotones (1926). La frase "mecánica cuántica" fue usada por primera vez en el paper de Max Born llamado Zur Quantenmechanik (La Mecánica Cuántica). En los años que siguen, esta base teórica lentamente comenzó a ser aplicada a estructuras, reacciones y enlaces químicos.
Descripción
En pocas palabras, en 1900 el físico alemán Max Plack introdujo la idea de que la energía estaba cuantizada, con el fin de derivar una fórmula para la dependencia de la frecuencia observada con la energía emitida por un cuerpo negro. En 1905, Einstein explicó el efecto fotoeléctrico por un postulado sobre que luz, o más específicamente toda la radiación electromagnética, puede ser dividida en un número finito de "cuantos de energía", que son localizados como puntos en el espacio. De la introducción del paper de cuántica On a heuristic viewpoint concerning the emission and transformation of light (Un punto de vista heurístico relacionado con la emisión y transformación de la luz) de marzo de 1905:
"De acuerdo a las suposiciones a ser contempladas aquí, cuando un rayo de luz se está propagando desde un punto, la energía no está distribuida continuamente sobre espacios cada vez más grandes, pero está constituida de un número finito de cuantos de energía que son localizados en puntos en el espacio, moviéndose sin dividirse y pudiendo ser absorbidos o generados sólo en su conjunto." Albert Einstein Esta sentencia ha sido llamada la sentencia más revolucionaria escrita por un físico en el siglo veinte.[1] Estos cuantos de energía serían llamados más tarde fotones, un término introducido por Gilbert N. Lewis en 1926. La idea que cada fotón tenía que consistir de energía en términos de cuantos fue un notable logro, ya que efectivamente eliminó la posibilidad que la radiación de un cuerpo negro alcanzara energía infinita, lo que se explicó en términos de formas de onda solamente. En 1913, Bohr explicó las líneas espectrales del átomo de hidrógeno, nuevamente utilizando cuantización, en su paper On the Constitution of Atoms and Molecules (Sobre la Constitución de Átomos y Moléculas), publicado en julio de 1913.
Estas teorías, aunque exitosas, fueron estrictamente fenomenológicas: no hay justificación rigurosa para la cuantización (de lado, quizás, para la discusión de Henri Poincaré sobre la teoría de Planck en su paper de 1912, Sur la théorie des quanta (Sobre la teoría cuántica)). Son conocidas mundialmente como la antigua teoría cuántica.
La frase "física cuántica" fue usada por primera vez en Planck's Universe in Light of Modern Physics (El Universo en Luz de la Física Moderna de Planck), de Johnston en 1931.
En 1924, el físico francés Louis-Victor de Broglie presenta su teoría de ondas de materia, por la que se indica que las partículas pueden exhibir características de onda y vice versa. Esta teoría fue para una partícula simple y derivada de la teoría especial de la relatividad. Basándose en el planteamiento de de Broglie, nació la mecánica cuántica moderna en 1925, cuando los físicos alemanes Werner Heisenberg y Max Born desarrollaron la mecánica matricial y el físico austríaco Erwin Schrödinger inventó la mecánica de ondas y la ecuación de Schrödinger no relativista como una aproximación al caso generalizado de la teoría de de Broglie.[2] Schrödinger posteriormente demostró que ambos enfoques eran equivalentes.
Heisenberg formuló su principio de incertidumbre en 1927, y la interpretación de Copenhague comienza a tomar forma cerca de la misma fecha. A partir de 1927, Paul Dirac comienza el proceso de unificación de la mecánica cuántica con la relatividad especial proponiendo la ecuación de Dirac para el electrón. La ecuación de Dirac alcanza la descripción relativista de la función de onda de un electrón que Schrödinger no pudo obtener. Predice el espín electrónico y ayuda a predecir la existencia del positrón. Fue pionero también en el uso de la teoría del operador, incluyendo la influyente notación cor-chete descrito en su famoso libro de 1930. Durante el mismo período, el matemático húngaro John von Neumann formuló la rigurosa base matemática para la mecánica cuántica de la teoría de los operadores lineales en los espacios de Hilbert, descrito en su igualmente famoso libro de 1932. Estos, como muchos otros trabajos del período fundacional aún siguen en pie, y son altamente utilizadas.
En el campo de la química cuántica fueron pioneros los físicos Walter Heitler y Fritz London, quienes publicaron un estudio de los enlaces covalentes de la molécula de hidrógeno en 1927. La química cuántica fue posteriormente desarrollada por un gran número de científicos, incluyendo el teórico químico norteamericano de Cal Tech Linus Pauling, y a John C. Slater en varias teorías tales como la teoría del orbital molecular o teoría de valencias.
A partir de 1927, se intentó aplicar la mecánica cuántica a los campos en vez de partículas simples, resultando en que fueron conocidas las teorías cuánticas de campo. Los primeros que trabajaron en esta área fueron Dirac, Pauli, Weisskopf y Jordan. Esta área de investigación culminó en la formulación de la electrodinámica cuántica por Feynman, Dyson, Schwinger y Tomonaga durante los 40'. La electrodinámica cuántica es una teoría cuántica de electrones, positrones y campo electromagnético, y sirvió como un modelo para posteriores teorías de campo cuántico. La teoría de la cromodinámica cuántica fue formulada a comienzos de los 60'. La teoría como la conocemos hoy en día fue formulada por Politzer, Gross y Wilczek en 1975. Basándose en el trabajo pionero de Schwinger, Higgs, Goldstone, Glashow, Weinberg y Salam, independientemente mostraron cómo la fuerza nuclar débil y la electrodinámica cuántica podían fusionarse en una sóla fuerza electrodébil.
Cronología
La siguiente tabla muestra los pasos y personas claves en el desarrollo de la mecánica cuántica y la química cuántica:
| Fecha
| Persona
| Contribución
|
| 1771
| Luigi Galvani
| Notó que los músculos de las ranas muertas se movían ligeramente cuando los golpeaba con un descargador eléctrico, a lo que se refirió como "electricidad animal".
|
| 1800
| Alessandro Volta
| Inventó la pila voltaica o batería, específicamente para refutar la teoría de la electricidad animal de Galvani.
|
| 1838
| Michael Faraday
| Usando la batería de Volta descubrió los rayos catódicos cuando, durante un experimento pasó corriente através de un tubo de vidrio lleno de un aire enrarecido y notó un extraño arco de luz comenzando en el ánodo (electrodo positivo) y finalizando en el cátodo (electrodo negativo).
|
| 1852
| Edward Frankland
| Inició la teoría de valencia, proponiendo que cada elemento fuese una específica "combinación de poder". Por ejemplo, algunos elementos como el nitrógeno tienden a combinarse con otros tres elementos (e.g. NO3), mientras que otros podrían tender a combinarse con cinco (PO5), y que cada elemento que se esfuerza por cumplir con su cuota de combinación de poder (valencia) para así satisfacer sus afinidades.
|
| 1859
| Gustav Kirchhoff
| Declaró el "problema del cuerpo negro": ¿cómo la intensidad de la radiación electromagnética emitida por un cuerpo negro depende de la frecuencia de la radiación y de la temperatura del cuerpo?
|
| 1877
| Ludwig Boltzmann
| Sugrió que los estados de energía de un sistema físico deberían ser discrtos.
|
| 1879
| William Crookes
| Mostró que los rayos catódicos (1938), a diferencia de los rayos de luz, pueden ser doblados en un campo magnético.
|
| 1885
| Johann Jakob Balmer
| Descubrió que las cuatro líneas visibles del espectro del hidrógeno podían ser asignadas enteras a una serie.
|
| 1888
| Johannes Rydberg
| Modificó la fórmula de Balmer para incluir las otras series de líneas y producir la fórmula de Rydberg.
|
| 1891
| Alfred Werner
| Propuso una teoría de afinidad y valencia en la cual la afinidad es una emisión de fuerza atractiva del centro del átomo la cual actúa uniformemente desde allí hacia todas las partes de la superficie esférica del átomo central.
|
| 1892
| Heinrich Rudolf Hertz
| Mostró que los rayos catódicos (1838) podían pasar a través de hojas delgadas de láminas de oro y producir una apreciable luminosidad de los cristales detrás de ellos.
|
| 1896
| Henri Becquerel
| Descubrió la "radiactividad", un proceso en el cual, debido a la desintegración nuclear, ciertos elementos o isótopos espontáneamente emiten uno de las tres entidades energéticas: partículas alfa (carga positiva), partículas beta (carga negativa) y partículas gama (carga neutral).
|
| 1897
| Joseph John Thomson
| Mostró que los rayos catódicos (1838) se curvan bajo la influencia de un campo eléctrico y un campo magnético y para explicar esto el sugirió que los rayos catódicos están negativamente cargados de partículas eléctricas subatómicas o corpúsculos" (electrones), sacados del átomo; y en 1904 propuso el modelo del "budín de ciruela, en el cual los átomos tienen una masa amorfa (budín) positivamente cargada como un cuerpo empotrado con electrones negativamente cargados (ciruelas) dispersos en su totalidad en la forma de anillos rotando de manera no aleatoria.
|
| 1900
| Max Planck
| Para explicar la radiación de cuerpo negro, sugirió que la energía electromagnética podría ser emitida sólo en forma cuantizada, esto es, la energía sólo podría ser un múltiplo de una unidad elemental de E = hf, donde h es la constante de Planck y f la frecuencia de la radiación.
|
| 1902
| Gilbert N. Lewis
| Para explicar la regla del octeto (1893), él desarrolló la teoría del átomo cúbico, en el cual los electrones en la forma de puntos estaban posicionados en la esquina de un cubo y sugirió que los enlaces simples, dobles y triples se dan cuando dos átomos se mantienen unidos por múltiples pares de electrones (un par por cada enlace) localizado entre los dos átomos (1916).
|
| 1904
| Richard Abegg
| Notó la existenacia de un patrón entre la diferencia numérica de la máxima valencia positiva, como +6 para H2SO4, y la máxima valencia negativa, como -2 para H2S, de un elemento que tiende a ser de ocho (regla de Abegg).
|
| 1905
| Albert Einstein
| Para explicar el efecto fotoeléctrico, esto es, la brillantez de la luz e ciertos materiales puede funcionar para sacar electrones del material, él postuló basado en la hipótesis cuántica de Planck (1900), que la luz en sí mismo consiste en sí misma de partículas cuánticas individuales (fotones).
|
| 1907
| Ernest Rutherford
| Para testear el modelo del budín de ciruelas (1904), él disparó partículas alfa (positivamente cargadas) en una lámina de oro y notó que algunos se devolvían, lo cual demuestra que los átomos tienen un pequeño núcleo atómico cargado positivamente en su centro.
|
| 1913
| Niels Bohr
| Para explicar la fórmula de Rydberg (1888), la cual modela correctamente el espectro de la emisión de luz del átomo de hidrógeno, postuló la hipótesis sobre que los electrones cargados negativamente giran en torno a un núcleo postivamente cargado en ciertas distancias "cuánticas" fijas, y que cada uno de estas "órbitas esféricas" tienen una energía específica asociada de tal manera que los movimientos de electrones entre las órbitas requiere emisiones "cuánticas" o absorciones de energía.
|
| 1916
| Arnold Sommerfeld
| Para describir el efecto Zeeman, esto es, que la absorción atómica o emisión de líneas espectrales cambien cuando la luz en primer lugar brilla a través de un campo magnético, el sugirió que allí podrían haber "órbitas elípticas" en los átomos además de las esféricas.
|
| 1919
| Irving Langmuir
| Basándose en el trabajo de Lewis (1916), el acuño el termino "covalencia" y postuló que los enlaces de coordinación ocurren cuando un par de electrones provienen del mismo átomo.
|
| 1922
| Stern y Gerlach
| El experimento de Stern y Gerlach detecta valores discretos de momentos angulares para los átomos en el estado base pasando a través de un campo magnético no homogéneo, conduciendo al descubrimiento del espín del electrón.
|
| 1923
| Louis-Victor de Broglie
| Postuló que los electrones en movimiento están asociados a longitudes de onda que están dadas por la constante de Planck h dividida por el momentum de mv = p del electrón: λ = h / mv = h / p.
|
| 1925
| Friedrich Hund
| Resumió la "regla de máxima multiplicidad", la cual establece que cuando los electrones son agregados sucesivamente a un átomo como muchos niveles u órbitas, son ocupados por separado antes de cualquier emparejamiento de electrones a diferencia de lo que ocurre con el espín, y hace la distinción que los electrones internos en las moleculas permanecen en los orbitales atómicos y sólo los electrones de valencia son necesitados para estar en los orbitales moleculares envueltos en ámbos nucleos.
|
| 1925
| Wolfgang Ernst Pauli
| Resumió el "principio de exclusión de Pauli", que dice que dos fermiones idénticos no pueden ocupar el mismo estado cuántico de manera simultánea.
|
| 1926
| Erwin Schrödinger
| Usando el postulado de de Broglie sobre las ondas de electrones (1924), desarrolló una "ecuación de onda" que representa matemáticamente la distribución de una carga de un electrón distribuido a través del espacio, siendo esféricamente simétrica o prominente en ciertas direcciones, es decir, dirigida a los enlaces de valencia, la cual dió el correcto valor para las líneas espectrales del átomo de hidrógeno.
|
| 1927
| Walter Heitler
| Usó la ecuación de onda de Schrödinger (1926) para mostrar cómo dos átomos hidrógenos se unen en función de ondas, con más, menos y términos de intercambio, para formar un enlace covalente.
|
| 1927
| Robert S. Mulliken
| En 1927 Mulliken trabajó en conjunto con Hund para desarrollar una teoría orbital molecular, donde los electrones son asignados a los estados que se extienden sobre toda la molécula, y en 1932 introdujo muchas nuevas terminologías de orbitales moleculares, como el enlace sigma, enlace pi y enlace delta.
|
| 1928
| Linus Pauling
| Resumió la naturaleza del enlace químico, usando el modelo de mecánica cuántico del enlace covalente de Heitler (1927) para sentar las bases de la mecánica cuántica para todos los tipos de estructuras y enlaces moleculares, y sugerir que diferentes tipos de enlaces en moléculas pueden ser igualados por el rápido desplazamiento de electrones, un proceso llamado "resonancia" (1931), como las resonacias híbridas conteniendo contribuciones de diferentes configuraciones electrónicas posibles.
|
| 1929
| John Lennard-Jones
| Introdujo una aproximación de la combinación lineal de orbitales atómicos para el cálculo de orbitales moleculares.
|
| 1932
| Werner Heisenberg
| Aplicó la teoría de perturbación para el porblema de los dos electrones y mostró como derivados de la resonancia del intercambio de electrones podía explicar la interacción de intercambio.
|
| 1938
| Charles Coulson
| Realizó el primer cálculo preciso de una función de onda de orbitales moleculares con la molécula de hidrógeno.
|
| 1951
| Roothaan y Hall
| Obtuvieron las ecuaciones de Roothaan-Hall, colocando rigurosos métodos de orbitales moleculares sobre una sólida base.
|
Primeros experimentos
- El experimento de la doble rendija de Thomas Young demotró la onda natural de la luz (c1805).
- Henri Becquerel descubrió la radiactividad (1896).
- El experimento del tubo de rayos catódicos de Joseph John Thomson (descubrió el electrón y su carga negativa) (1897).
- El estudio de la radiación de cuerpo negro entre los años 1850 y 1900, lo cual no podía ser explicado sin los conceptos cuánticos.
- El efecto fotoeléctrico: Einstein explicó esto en 1905 (por lo cual recibiría el premio Nobel) usando los conceptos de fotones, partículas de luz con energía cuantizada.
- El experimento de la gota de aceite de Robert Andrews Millikan, el cual mostraba que la carga eléctrica ocurre como cuantos (unidades enteras) (1909).
- El experimento de la lámina de oro de Ernest Rutherford refutó el modelo del budín de ciruelas del átomo, el cual sugería que la masa y la carga positiva de los átomos están casi uniformemente distribuidos (1911).
- Otto Stern y Walter Gerlach dirigieron el experimento de Stern-Gerlach, el cual demostró la naturaleza cuantizada del espín de las partículas.
- Clinton Joseph Davisson y Lester Germer demostraron la naturaleza de onda del electrón[3] en el experimento de la difracción de electrones (1927).
- Clyde Cowan y Frederick Reines confirman la existencia del neutrino en el experimento del neutrino (1955).
- El experimento de la doble rendija de Claus Jönsson con electrones.
- El efecto cuántico de Hall, descubierto por Klaus von Klitzing en 1980. En cuantizó la versión del efecto Hall que permitió la definición de un nuevo estándar práctico para la resistencia eléctrica y para una extremadamente precisa determinación independiente de la constante de estructura fina.
- La verificación experimental del entrelazamiento cuántico realizada por Alain Aspect en 1982
Referencias
- ↑ Folsing, Albrecht (1997). Albert Einstein: A Biography. trans. Ewald Osers, Viking.
- ↑ Hanle, P.A. (1977). Erwin Schrodinger's Reaction to Louis de Broglie's Thesis on the Quantum Theory. Isis, Vol. 68, No. 4 (Dec., 1977), pp. 606-609.
- ↑ El experimento de Davisson-Germer, el cual demuestra la naturaleza de onda del electrón.
Véase también
Enlaces externos
- Una historia de la mecánica cuántica (en inglés).
- Una breve historia de la mecánica cuántica (en inglés).
- Historia y cimientos de la física cuántica (en inglés).
|


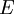 , tal que cada uno de estos elementos de energía sea proporcional a la frecuencia
, tal que cada uno de estos elementos de energía sea proporcional a la frecuencia 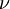 , con las que cada uno podía de manera individual irradiar energía,
como lo muestra la siguiente fórmula:
, con las que cada uno podía de manera individual irradiar energía,
como lo muestra la siguiente fórmula: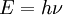
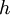 es un valor numérico llamado
es un valor numérico llamado 




