El experimento muestra por primera vez en detalle cómo los electrolitos se vuelven metálicos
La transición al estado se muestra por un cambio de color de azul a oro
Anuncios
Un equipo internacional ha desarrollado una sofisticada técnica experimental en BESSY II para observar la formación de una banda de conducción metálica en los electrolitos. Para ello, el equipo preparó primero soluciones criogénicas de amoníaco líquido que contenían diferentes concentraciones de metales alcalinos. El color de las soluciones cambia con la concentración de azul a dorado a medida que los átomos individuales de metal en solución pasan a un compuesto metálico. A continuación, el equipo examinó estos chorros líquidos utilizando rayos X blandos en BESSY II y posteriormente ha podido analizar este proceso en detalle a partir de los datos que adquirieron combinados con predicciones teóricas. El trabajo ha sido publicado en Science y aparece incluso en la portada.
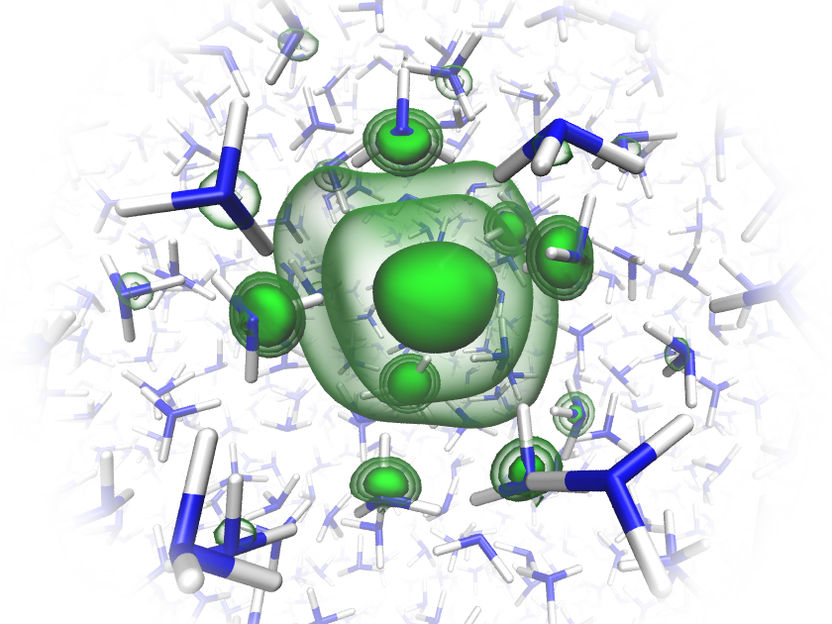
Los teóricos del equipo han simulado elaboradamente la estructura del electrón disuelto en amoníaco líquido.
© Charles Universität Prag/O. Maršálek & T. Martinek

A baja concentración de los electrones disueltos la solución de amoníaco es azul.
© HZB

En general se comprende bien lo que distingue a los metales de otros materiales. En un metal, algunos de los electrones externos de los átomos se mueven a través de la red cristalina en lo que se llama una banda de conducción. Así es como los metales conducen la corriente eléctrica. A diferencia de los metales, los iones de los electrolitos están desordenados y la conductividad eléctrica incluso disminuye al aumentar la concentración de iones. Entonces, ¿cómo surge el comportamiento metálico de los muchos átomos metálicos individuales disueltos en el electrolito? ¿A qué concentración y exactamente cómo se forma una banda de conducción, y cómo se comportan los orbitales de los electrones durante este proceso?
Una gran colaboración internacional ha desarrollado ahora una sofisticada técnica experimental que permite observar estos procesos por primera vez. 17 autores de renombrados institutos de Kioto, Los Ángeles, París, Praga y Berlín han aportado sus conocimientos.
Uno de los principales autores es el Dr. Bernd Winter del Fritz-Haber-Institut de Berlín, que organizó el experimento en BESSY II junto con el Dr. Robert Seidel, jefe del Grupo de Jóvenes Investigadores de Fotoquímica Interfacial HZB Operando y su equipo. Como primer paso, los físicos disolvieron metales alcalinos como el litio y el sodio en amoníaco, formando soluciones. Los átomos de metal se convierten en iones con carga positiva y sus electrones externos son atraídos hacia la solución líquida de amoníaco. Estas soluciones son ligeramente azules a bajas concentraciones de metal, pero a medida que la concentración de metal aumenta, el color azul se hace más intenso hasta que pasa a un tono dorado. Este sorprendente cambio de color está relacionado con los estados de los electrones en los metales disueltos, según asumieron los científicos.
Utilizando el instrumento SOL³PES en la línea de haz BESSY II U49/2-PGM-1 que supervisa Seidel, el equipo pudo estudiar diferentes concentraciones de las soluciones de metales alcalinos y amoníaco en forma de chorros líquidos extremadamente estrechos bajo vacío ultra alto utilizando la espectroscopia de fotoelectrones. Las soluciones tuvieron que ser enfriadas a unos -60 grados centígrados. A esta temperatura, el amoníaco es un líquido y su evaporación es suficientemente baja. Esto les permitió medir con precisión la transición de electrolito a metal.
"Pudimos por primera vez capturar la señal de fotoelectrones del exceso de electrones en el amoníaco líquido. Observamos un pico estrecho de unos 2 electrones-voltios (eV), lo que indica la presencia de electrones y dielectrones disueltos", dice Winter. Seidel añade: "Esto también explica por qué la solución es inicialmente azul en concentraciones bajas y medias de iones metálicos: la solución absorbe la luz en la región roja, que corresponde al pico a 2 eV". Como resultado, la solución aparece ligeramente azul mientras sólo haya electrones individuales disueltos. Este color azul se intensifica con la aparición de los primeros "pares de electrones", llamados dielectrones. El color cambia a dorado a medida que aumenta la concentración de metales alcalinos. Al mismo tiempo, este estrecho pico de absorción se ensancha en una banda con un borde Fermi agudo en el espectro, como es característico de los metales, acompañado también por señales asociadas a excitaciones colectivas (plasmones) - características de los electrones metálicos libres.
"Los grupos encabezados por los teóricos Pavel Jungwirth y Ondrej Marsalek en Praga habían sido capaces de modelar la estructura electrónica de los electrones disueltos en solución con antelación", dice Winter. "Encontramos que las energías de unión que calcularon encajan muy bien con nuestros valores determinados experimentalmente. Esto nos dio confianza en nuestra interpretación de los datos de los rayos X".
El trabajo se ha publicado en Science porque supone una importante contribución a la comprensión fundamental de la transición de un carácter no conductor a metálico en los electrolitos. Además, hay incluso aplicaciones prácticas de los electrones disueltos, es decir, de los electrones en solución, en la química orgánica como agentes reductores de sistemas aromáticos, en los electrolitos de las baterías y en los condensadores electrónicos.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.











































