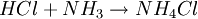|
El cloruro de amonio es una sal de amonio cuya fórmula química es NH4Cl. Producto destacado
SíntesisLa síntesis del cloruro de amonio se produce a partir de vapores de cloruro de hidrógeno y de amoniaco:
Propiedades físicasEn estado sólido la coloración varía entre incoloro y blanco. Es inodoro e higroscópico en diversas formas. Su punto de sublimación es de 350°C. Su densidad relativa (agua = 1) es 1,5. La presión de vapor que genera es de 0.13 kPa a 160°C. Su masa molecular es de: 53.49 g/mol. Farmacología y mecanismos de acciónComo diuréticoEl cloruro de amonio aumenta la excreción renal de cloruros y causa una respuesta diurética en personas normales o con edema. Se utilizó en un tiempo en el edema causado por la enfermedad de Läennec. Cuando el cloruro de amonio es administrado a dosis de 9 g al día, la diuresis aumenta progresivamente durante la primera semana. A los dos o tres días comienza a elevarse la excreción de sodio. Como acidificanteEl cloruro de amonio eleva la acidez al incrementar la concentración de hidrogeniones (H+) libres. La dosis es la misma que en su uso como diurético. Como expectoranteSe sabe que el cloruro de amonio actúa irritando la mucosa, causando estimulación refleja de las glándulas de la mucosa bronquial. FarmacocinéticaEl cloruro de amonio se absorbe fácilmente desde la vía gastrointestinal en unas 5-6 horas tras la ingestión. Su metabolismo se efectúa en el hígado y su excreción es por la orina. Precauciones especialesEl cloruro de amonio se contraindica en personas con cirrosis y otras enfermedades hepáticas en virtud de que se puede almacenar y causar intoxicación por el amoníaco. El cloruro de amonio nunca debe usarse como único tratamiento de la acidosis metabólica en pacientes con disfunción renal grave. Los médicos deben juzgar el uso del cloruro de amonio en pacientes con edema cardíaco o insuficiencia pulmonar debido a que puede existir un trastorno acidobásico intenso. El uso de espironolactona o inhibidores de la anhidrasa carbónica como la acetazolamida puede precipitar una acidosis sistémica. Reacciones adversas conocidasLos efectos secundarios van desde cefalea, confusión, letargo, hiperventilación, bradicardia, irritación gástrica, vómitos, sed, diarrea, anorexia, glucosuria, hipocalemia, tetania, hiponatremia. Uso en químicaSe utiliza el cloruro de amonio como catalizador en la síntesis de Strecker. Solubilidad en agua
Peligros químicosLa sustancia se descompone al calentarla intensamente o al arder, produciendo humos tóxicos e irritantes de óxidos de nitrógeno, amoníaco y cloruro de hidrógeno. La disolución en agua es un ácido débil. Reacciona violentamente con nitrato amónico y clorato potásico, originando peligro de incendio y explosión. Reacciona con concentrados de ácidos para formar cloruro de hidrógeno y bases fuertes para formar amoníaco. Reacciona con sales de plata para formar compuestos sensibles al choque. Ataca al cobre y compuestos. Límites de exposiciónTLV (como TWA): 10 mg/m³ (humos) (ACGIH 1995-1996). TLV (como STEL): 20 mg/m³ (humos) (ACGIH 1995-1996). MAK no establecido. Vías de exposiciónLa sustancia se puede absorber por inhalación del polvo o humo y por ingestión. Es muy tóxica. AlmacenamientoSe almacena separado de: nitrato amónico, clorato potásico, ácidos, álcalis, sales de plata. Se recomienda mantenerlo en un lugar seco. Véase tambiénCategoría: Cloruros |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Este articulo se basa en el articulo Cloruro_de_amonio publicado en la enciclopedia libre de Wikipedia. El contenido está disponible bajo los términos de la Licencia de GNU Free Documentation License. Véase también en Wikipedia para obtener una lista de autores. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||

Último visto