Los investigadores desarrollan un proceso de catálisis sostenible
El método permite oxidaciones sostenibles relacionadas con las reacciones enzimáticas
Los acetales son importantes compuestos químicos que se utilizan, por ejemplo, en la producción de ciertos agentes médicos. Un nuevo método hace ahora que su síntesis sea más fácil y más respetuosa con el medio ambiente. Los químicos de la Universidad de Bonn han desarrollado y optimizado el proceso catalítico sostenible. También se utilizaron simulaciones informáticas de última generación. La reacción se basa en un mecanismo que se da con frecuencia en la naturaleza, pero que hasta ahora se ha utilizado muy poco en la síntesis química.
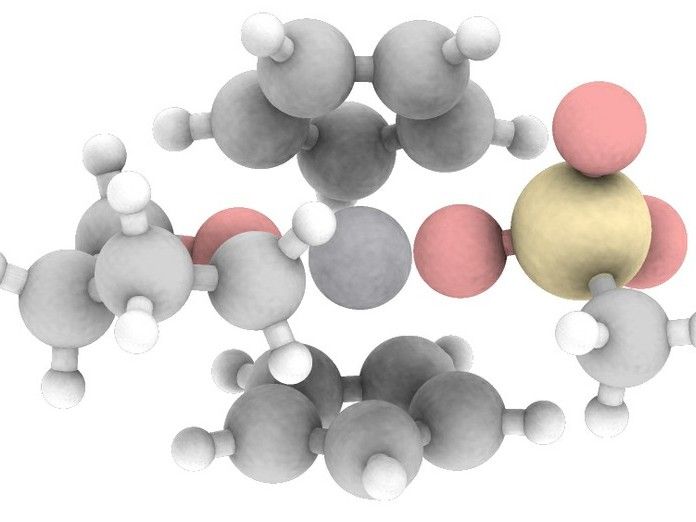
La estructura generada por ordenador del complejo catalizador con el titanio reducido en el centro activo.
© AG Prof. Grimme, Fabian Bohle/Universität Bonn
El paso clave en la producción de acetales es la unión de dos átomos de oxígeno a un átomo de carbono. Los químicos a menudo logran este arreglo con la oxidación. Normalmente se utilizan agentes oxidantes fuertes para lograrlo liberando un átomo de oxígeno durante la reacción. El resto del agente oxidante debe ser eliminado después de la síntesis.
"En nuestro estudio, sin embargo, describimos un camino que se denomina atómico-económico, lo que significa que no genera residuos", explica el Prof. Dr. Andreas Gansäuer del Instituto Kekulé de Química Orgánica y Bioquímica de la Universidad de Bonn. "La propia molécula inicial ya contiene el átomo de oxígeno necesario para la oxidación. La catálisis que hemos desarrollado simplemente desplaza este oxígeno en la molécula, que crea el acetal."
La molécula inicial contiene un llamado grupo epoxídico, una especie de "triángulo" en el que dos esquinas están formadas por átomos de carbono y la tercera por un átomo de oxígeno. Estos anillos triples están bajo una gran tensión y por lo tanto se rompen fácilmente en el átomo de oxígeno. Los epoxis almacenan la energía de reacción necesaria como un resorte comprimido.
La catálisis basada en el modelo de la naturaleza
Para lograr este objetivo se requiere un catalizador adecuado. Hablando en sentido figurado, los átomos de oxígeno tienen dos "brazos" con los que pueden formar enlaces. Si el anillo epoxídico se rompe, uno de estos brazos se libera. El catalizador ahora se une a él temporalmente. Esto inicia una secuencia de reordenamiento interno de las moléculas (intramolecular). Al final de esta secuencia, el átomo de oxígeno libera el catalizador de nuevo y en su lugar se une al carbono deseado. "Este paso se llama rebote de oxígeno", dice Gansäuer.
Este mecanismo se ha utilizado raramente en las síntesis químicas hasta la fecha, a diferencia de lo que ocurre en la naturaleza: El hígado, por ejemplo, utiliza el "rebote de oxígeno" para descomponer las toxinas. Esto también requiere catalizadores, las llamadas enzimas P450. Su centro activo contiene un átomo de hierro. "El corazón de nuestro catalizador también consiste en un metal común y no tóxico, a saber, el titanio", explica el Prof. Dr. Stefan Grimme del Instituto de Física y Química Teórica de la Universidad de Bonn.
Sintonización del catalizador en el ordenador
Durante la síntesis del acetal, el titanio absorbe primero un átomo de oxígeno y luego lo libera de nuevo (a la oxidación le sigue la llamada reducción). Esto sólo funciona de manera efectiva si se une el oxígeno con suficiente fuerza a sí mismo sin "aferrarse" demasiado. Para ajustar adecuadamente su afinidad con el oxígeno, el titanio se une a ciertas moléculas, sus ligandos. Dependiendo del ligante, el metal tiene entonces un efecto oxidante algo más fuerte o puede reducirse más fácilmente. Las "moléculas de afinación" más adecuadas se seleccionan hoy en día con la ayuda de un ordenador. El grupo de investigación en torno al Prof. Grimme se especializa en esta tarea: En los últimos años, ha desarrollado algoritmos que permiten simulaciones muy rápidas de las propiedades de los catalizadores.
Esto permitió a los investigadores en su estudio optimizar su catalizador para que convierta completamente el material de partida en el acetal deseado. "El resultado documenta muy bien lo útil que es la estrecha cooperación entre el experimento y la teoría para desarrollar métodos de catálisis sostenibles", enfatiza Gansäuer.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.










































