Combustibles solares de nueva generación: cómo un catalizador de cobre que bate récords convierte el CO₂ en combustibles líquidos
Los investigadores han filmado en tiempo real la evolución de las nanopartículas de cobre para convertir el dióxido de carbono y el agua en combustibles renovables y productos químicos
Desde la década de 1970, los científicos saben que el cobre tiene una capacidad especial para transformar el dióxido de carbono en valiosos productos químicos y combustibles. Pero durante muchos años, los científicos se han esforzado por comprender cómo funciona este metal común como electrocatalizador, un mecanismo que utiliza la energía de los electrones para transformar químicamente moléculas en diferentes productos.

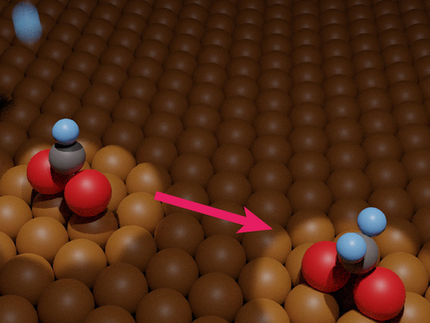
Representación artística de una nanopartícula de cobre evolucionando durante la electrólisis del CO2: Las nanopartículas de cobre (izquierda) se combinan en "nanogranos" de cobre metálico más grandes (derecha) en cuestión de segundos de la reacción electroquímica, reduciendo el CO2 en nuevos productos multicarbono.
Yao Yang/Berkeley Lab
Ahora, un equipo de investigación dirigido por el Laboratorio Nacional Lawrence Berkeley (Berkeley Lab) ha obtenido nuevos conocimientos captando películas en tiempo real de nanopartículas de cobre (partículas de cobre diseñadas a la escala de la milmillonésima parte de un metro) mientras conviertenCO2 y agua en combustibles renovables y productos químicos: etileno, etanol y propanol, entre otros. El trabajo se publica en la revista Nature.
"Es muy emocionante. Tras décadas de trabajo, por fin podemos demostrar, con pruebas irrefutables, que los electrocatalizadores de cobre destacan en la reducción deCO2 ", declaró Peidong Yang, científico titular de las Divisiones de Ciencias de los Materiales y Ciencias Químicas del Laboratorio de Berkeley que dirigió el estudio. Yang es también catedrático de Química y Ciencia e Ingeniería de Materiales en la Universidad de Berkeley. "Saber cómo el cobre es un electrocatalizador tan excelente nos acerca a convertirel CO2 en nuevos combustibles solares renovables mediante fotosíntesis artificial".
El trabajo ha sido posible gracias a la combinación de una nueva técnica de obtención de imágenes denominada STEM (microscopía electrónica de transmisión por barrido) de celda líquida electroquímica 4D operando con una sonda de rayos X blanda para investigar el mismo entorno de muestra: nanopartículas de cobre en líquido. El primer autor, Yao Yang, becario postdoctoral Miller de la Universidad de Berkeley, concibió el innovador método bajo la dirección de Peidong Yang mientras realizaba su doctorado en química en la Universidad de Cornell.
Los científicos que estudian los materiales y las reacciones de la fotosíntesis artificial han querido combinar la potencia de una sonda de electrones con la de los rayos X, pero ambas técnicas no pueden realizarse normalmente con el mismo instrumento.
Los microscopios electrónicos (como STEM o MET) utilizan haces de electrones y destacan en la caracterización de la estructura atómica en partes de un material. En los últimos años, los instrumentos STEM 4D (o "trama 2D de patrones de difracción 2D mediante microscopía electrónica de transmisión por barrido"), como los de la Molecular Foundry del Berkeley Lab, han ampliado aún más los límites de la microscopía electrónica, permitiendo a los científicos cartografiar regiones atómicas o moleculares en una gran variedad de materiales, desde el duro vidrio metálico hasta las películas blandas y flexibles.
Por otro lado, los rayos X blandos (o de menor energía) son útiles para identificar y seguir reacciones químicas en tiempo real en un entorno operando, o del mundo real.
Pero ahora los científicos pueden tener lo mejor de ambos mundos. El núcleo de la nueva técnica es un portamuestras electroquímico de "célula líquida" de gran versatilidad. Mil veces más fino que un cabello humano, el dispositivo es compatible con instrumentos STEM y de rayos X.
El diseño ultrafino de la célula líquida electroquímica permite obtener imágenes fiables de muestras delicadas, protegiéndolas al mismo tiempo de los daños causados por los haces de electrones. Un electrodo especial diseñado a medida por el coautor Cheng Wang, científico del Advanced Light Source del Laboratorio de Berkeley, permitió al equipo realizar experimentos de rayos X con la célula líquida electroquímica. La combinación de ambos métodos permite a los investigadores caracterizar de forma exhaustiva las reacciones electroquímicas en tiempo real y a escala nanométrica.
Granularidad
Durante los experimentos 4D-STEM, Yao Yang y su equipo utilizaron la nueva célula electroquímica líquida para observar cómo las nanopartículas de cobre (de tamaños comprendidos entre 7 y 18 nanómetros) evolucionaban hasta convertirse en nanogranos activos durante la electrólisisdel CO2, un proceso que utiliza la electricidad para impulsar una reacción en la superficie de un electrocatalizador.
Los experimentos revelaron una sorpresa: las nanopartículas de cobre se combinaron en "nanogranos" de cobre metálico de mayor tamaño en cuestión de segundos tras la reacción electroquímica.
Para saber más, el equipo recurrió a Wang, pionero de una técnica conocida como "dispersión resonante de rayos X blandos (RSoXS) para materiales blandos" en el Advanced Light Source hace más de 10 años.
Con la ayuda de Wang, el equipo de investigación utilizó la misma célula electroquímica líquida, pero esta vez durante los experimentos RSoXS, para determinar si los nanogranos de cobre facilitan la reducción delCO2 . Los rayos X blandos son ideales para estudiar cómo evolucionan los electrocatalizadores de cobre durante la reducción deCO2, explicó Wang. Con RSoXS, los investigadores pueden seguir en tiempo real múltiples reacciones entre miles de nanopartículas e identificar con precisión los reactivos químicos y los productos.
Los experimentos de RSoXS en la Advanced Light Source, junto con otras pruebas obtenidas en la Cornell High Energy Synchrotron Source (CHESS), demostraron que los nanogranos de cobre metálico actúan como sitios activos para la reducción delCO2. (El cobre metálico, también conocido como cobre(0), es una forma del elemento cobre).
Durante la electrólisisdel CO2, las nanopartículas de cobre cambian su estructura durante un proceso llamado "revuelto electroquímico". La capa superficial de óxido de las nanopartículas de cobre se degrada, creando sitios abiertos en la superficie del cobre para que se adhieran las moléculasde CO2, explicó Peidong Yang. Y a medida queel CO2 se "acopla" a la superficie de los nanogranos de cobre, los electrones se transfieren alCO2, provocando una reacción que produce simultáneamente etileno, etanol y propanol junto con otros productos multicarbono.
"Los nanogranos de cobre se convierten en pequeñas fábricas de productos químicos", explica Yao Yang.
Otros experimentos realizados en la Fundición Molecular, la Fuente de Luz Avanzada y el CHESS revelaron que el tamaño importa. Todas las nanopartículas de cobre de 7 nanómetros participaron en la reducción deCO2, mientras que las nanopartículas más grandes no lo hicieron. Además, el equipo descubrió que sólo el cobre metálico puede reducir eficazmente elCO2 en productos multicarbono. Los resultados tienen implicaciones para "diseñar racionalmente electrocatalizadores deCO2 eficientes", dijo Peidong Yang.
El nuevo estudio también validó los hallazgos de Peidong Yang de 2017: Que las nanopartículas de cobre de 7 nanómetros de tamaño requieren bajos aportes de energía para iniciar la reducción deCO2. Como electrocatalizador, las nanopartículas de cobre de 7 nanómetros necesitaron una fuerza motriz récord, unos 300 milivoltios menos que los electrocatalizadores de cobre a granel típicos. Los catalizadores más eficaces para obtener productos multicarbono a partir deCO2 suelen funcionar con una fuerza motriz de 1 voltio.
Los nanogranos de cobre podrían aumentar la eficiencia energética y la productividad de algunos catalizadores diseñados para la fotosíntesis artificial, un campo de investigación cuyo objetivo es producir combustibles solares a partir de luz solar, agua yCO2. Actualmente, los investigadores de la Liquid Sunlight Alliance (LiSA), financiada por el Departamento de Energía, planean utilizar los catalizadores de nanogranos de cobre en el diseño de futuros dispositivos de combustible solar.
"La capacidad de la técnica para grabar películas en tiempo real de un proceso químico abre interesantes oportunidades para estudiar muchos otros procesos electroquímicos de conversión de energía. Es un gran avance, y no habría sido posible sin Yao y su trabajo pionero", declaró Peidong Yang.
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.