Lo que el calor puede decirnos sobre la química de las pilas
Utilización del efecto Peltier para estudiar las células de iones de litio
Anuncios
Las baterías suelen estudiarse a partir de sus propiedades eléctricas, como el voltaje y la corriente, pero una nueva investigación sugiere que observar cómo fluye el calor junto con la electricidad puede aportar importantes conocimientos sobre la química de las baterías.
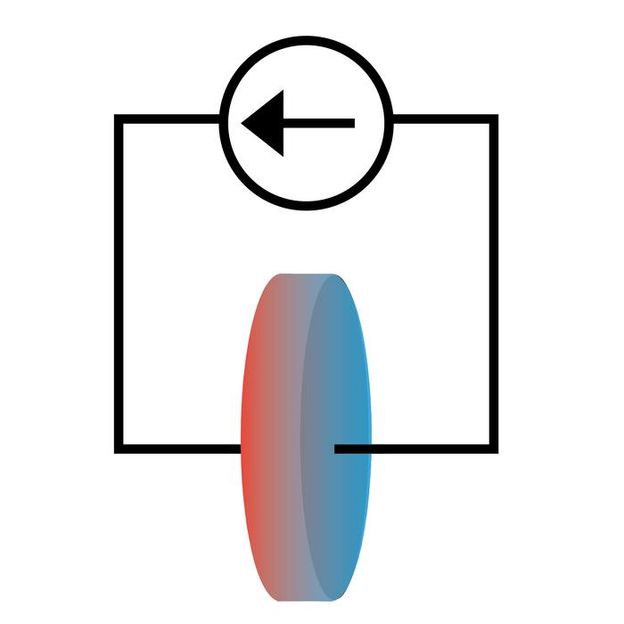
Los investigadores estudiaron cómo la corriente eléctrica creaba flujos de calor en una célula de batería de iones de litio. El calor fluía en sentido contrario a la corriente eléctrica, lo que se traducía en una mayor temperatura en el lado por el que la corriente entraba en la célula.
The Grainger College of Engineering at University of Illinois Urbana-Champaign
Un equipo de investigadores de la Universidad de Illinois Urbana-Champaign ha demostrado cómo estudiar las propiedades químicas de las pilas de iones de litio aprovechando el efecto Peltier, en el que la corriente eléctrica hace que un sistema se caliente. Esta técnica, que se publica en la revista Physical Chemistry Chemical Physics, les ha permitido medir experimentalmente la entropía del electrolito de iones de litio, una característica termodinámica que podría influir directamente en el diseño de las baterías de iones de litio.
"Nuestro trabajo trata de comprender la termodinámica fundamental de los iones de litio disueltos, información que esperamos sirva de guía para el desarrollo de mejores electrolitos para baterías", explica David Cahill, profesor de Ciencia e Ingeniería de Materiales de la U. de I. y director del proyecto. "Medir el transporte acoplado de carga eléctrica y calor en el efecto Peltier nos permite deducir la entropía, una cantidad que está estrechamente relacionada con la estructura química de los iones disueltos y cómo interactúan con otras partes de la batería".
El efecto Peltier está muy estudiado en los sistemas de estado sólido, donde se utiliza en refrigeración y enfriamiento. Sin embargo, permanece en gran medida inexplorado en sistemas iónicos como el electrolito de litio. La razón es que las diferencias de temperatura creadas por el calentamiento y el enfriamiento Peltier son pequeñas en comparación con otros efectos.
Para superar este obstáculo, los investigadores utilizaron un sistema de medición capaz de resolver una cienmilésima de grado Celsius. Esto permitió a los investigadores medir el calor entre los dos extremos de la célula y utilizarlo para calcular la entropía del electrolito de iones de litio de la célula.
"Estamos midiendo una propiedad macroscópica, pero revela información importante sobre el comportamiento microscópico de los iones", explica Rosy Huang, estudiante de posgrado del grupo de investigación de Cahill y coautora principal del estudio. "Las mediciones del efecto Peltier y de la entropía de la solución están estrechamente relacionadas con la estructura de solvatación. Anteriormente, los investigadores de baterías se basaban en mediciones de energía, pero la entropía proporcionaría un importante complemento a esa información que ofrece una imagen más completa del sistema."
Los investigadores estudiaron cómo cambiaba el flujo de calor Peltier con la concentración de iones de litio, el tipo de disolvente, el material del electrodo y la temperatura. En todos los casos, observaron que el flujo de calor era opuesto a la corriente iónica en la solución, lo que implica que la entropía de la disolución de los iones de litio es menor que la entropía del litio sólido.
La capacidad de medir la entropía de las soluciones electrolíticas de iones de litio puede aportar información importante sobre la movilidad de los iones, que rige el ciclo de recarga de la batería, y sobre cómo interactúa la solución con los electrodos, un factor importante en la vida útil de la batería.
"Un aspecto poco valorado del diseño de baterías es que el electrolito líquido no es químicamente estable en contacto con los electrodos", explica Cahill. "Siempre se descompone y forma algo llamado interfase sólido-electrolito. Para que una batería sea estable durante ciclos largos, hay que entender la termodinámica de esa interfase, que es lo que ayuda a hacer nuestro método".
Nota: Este artículo ha sido traducido utilizando un sistema informático sin intervención humana. LUMITOS ofrece estas traducciones automáticas para presentar una gama más amplia de noticias de actualidad. Como este artículo ha sido traducido con traducción automática, es posible que contenga errores de vocabulario, sintaxis o gramática. El artículo original en Inglés se puede encontrar aquí.














































